Vaccine Covivac đạt yêu cầu về tính an toàn, khả năng dung nạp và sinh kháng thể trung hòa cao hơn so với vaccine đối chứng là AstraZeneca, đủ điều kiện chuyển sang nghiên cứu giai đoạn ba.
Ngày 8/2, đại diện nhóm nghiên cứu cho biết đây là kết luận của Hội đồng Đạo đức trong nghiên cứu y sinh học Quốc gia (gọi tắt là Hội đồng) hôm 29/12/2021, dựa trên báo cáo kết quả giữa kỳ thử nghiệm lâm sàng giai đoạn hai vaccine Covivac. Cùng với báo cáo giữa kỳ của giai đoạn một, Hội đồng kết luận "vaccine đủ điều kiện để chuyển sang nghiên cứu giai đoạn ba, mức liều được khuyến cáo là 10 mcg".
Hiện nhóm nghiên cứu chưa công bố kế hoạch chi tiết về giai đoạn ba nghiên cứu Covivac. Trước đó, Viện Vaccine và Sinh phẩm Y tế (IVAC - đơn vị nghiên cứu, phát triển Covivac) hoãn nghiên cứu giai đoạn ba do thiếu người tình nguyện đủ điều kiện thử nghiệm. Trong tình hình mới, IVAC có hướng chuyển nghiên cứu liều vaccine nhắc lại, bổ sung, tuy nhiên tiếp tục hoãn thử nghiệm vì vướng mắc về cơ chế, chính sách cấp phép. Về vấn đề này, đại diện Bộ Y tế cho biết sẽ họp các bên liên quan và có thông tin chính thức.
Đại diện nhóm nghiên cứu cũng cung cấp báo cáo kết quả giữa kỳ vaccine Covivac từ IVAC. Trong đó, ở giai đoạn hai, vaccine thử nghiệm trên 374 người tình nguyện tuổi 18-59 và 60 tuổi trở lên, tại huyện Vũ Thư, tỉnh Thái Bình, so sánh (đối chứng) với vaccine AstraZeneca. Người tình nguyện được chia thành 3 nhóm theo tỷ lệ 1:1:1. Hai nhóm tiêm vaccine Covid-19 với mức liều 3 mcg hoặc 6 mcg và một nhóm tiêm vaccine AstraZeneca (AZD1222), các mũi tiêm cách nhau 28 ngày.
 Vaccine Covivac tại Viện Vaccine và Sinh phẩm y tế (IVAC), Nha Trang. Ảnh:Xuân Ngọc
Vaccine Covivac tại Viện Vaccine và Sinh phẩm y tế (IVAC), Nha Trang. Ảnh:Xuân Ngọc
Nhóm nghiên cứu đánh giá an toàn tại chỗ và toàn thân của người thử nghiệm sau tiêm 30 phút, trong vòng 7 ngày, 28 ngày sau mũi một và hai; lấy mẫu máu để xét nghiệm, đo lường kháng thể trung hòa nCoV. Tất cả xét nghiệm này được thực hiện tại Nexelis, Canada; kết quả miễn dịch được gửi đến tổ chức BIOPHICS ở Thái Lan để phân tích số liệu và viết báo cáo. Trong đó, 374 người tiêm mũi một và 371 người tiêm mũi hai.
Tính an toàn của vaccine được đánh giá thông qua kết quả về các biến cố bất lợi (Adverse event - AE), chia ra các mục nhỏ gồm phản ứng tại chỗ dự kiến trong vòng 7 ngày như đau tại vị trí tiêm, sưng tấy, đỏ; phản ứng toàn thân trong dự kiến trong vòng 7 ngày gồm sốt, đau đầu, mệt mỏi hoặc khó chịu, đau cơ...; biến cố bất lợi ngoài dự kiến đến ngày 28 được đo bằng tỷ lệ người thử nghiệm bất kỳ một phản ứng phụ nào trong số đã nêu trên; biến cố cần thăm khám y tế; biến cố bất lợi nghiêm trọng; biến cố được quan tâm đặc biệt; tỷ lệ liên quan Covid-19; đe dọa tính mạng, tử vong...
Báo cáo cho thấy các phản ứng phụ sau 7 ngày tiêm mũi hai thấp hơn so với mũi một. Trong đó, 3,2% tình nguyện viên phải khám y tế sau tiêm mũi một và 2,7% cần khám sau mũi hai, phản ứng đều ở mức độ nhẹ và vừa. Ba trường hợp xảy ra phản ứng phụ nghiêm trọng sau tiêm song được đánh giá là không liên quan vaccine. Về tỷ lệ mắc Covid-19 liên quan vaccine, đe dọa tính mạng, tử vong, nhóm nghiên cứu không ghi nhận trường hợp nào.
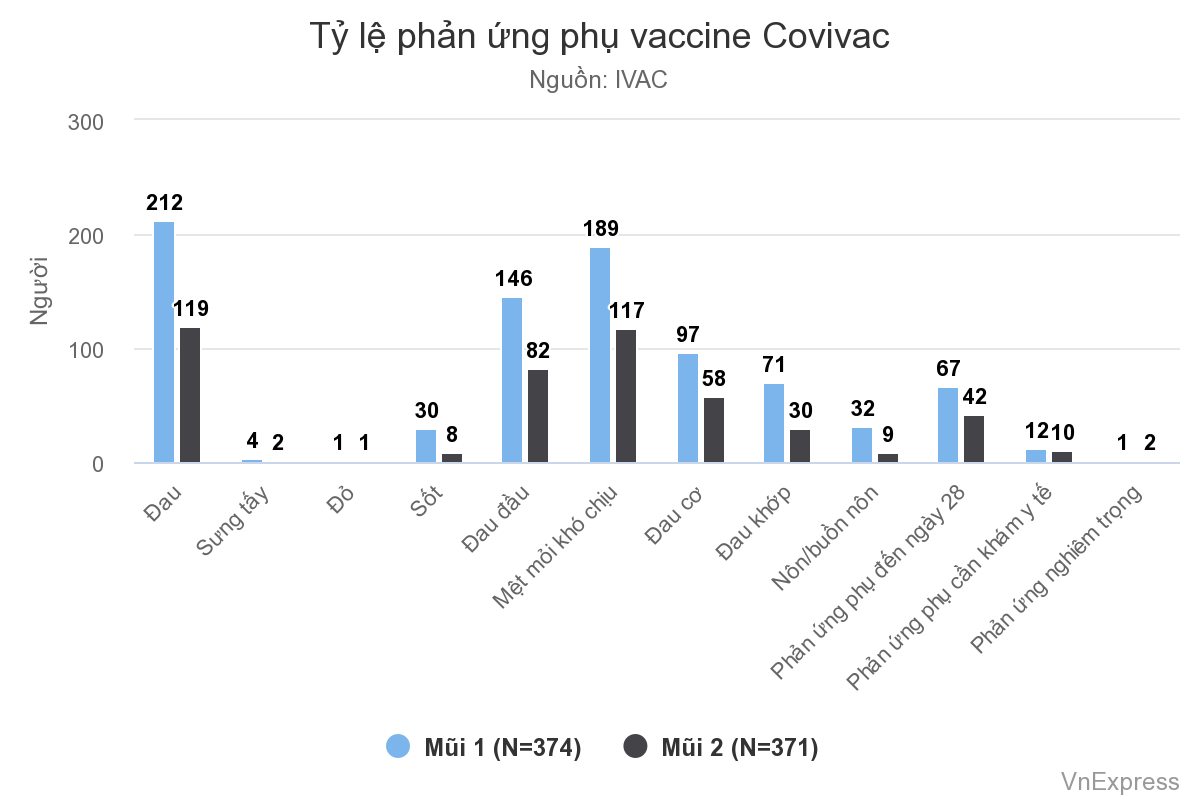
Báo cáo cũng cho biết các biến cố bất lợi tại chỗ và toàn thân của vaccine Covivac ở nhóm 18-59 tuổi, trên 60 tuổi tương đương nhau và tương tự với vaccine đối chứng.
Về kết quả miễn dịch, vaccine sinh kháng thể trung hòa cao hơn AstraZeneca, song các kết quả còn cần khẳng định trong giai đoạn ba với quy mô nghiên cứu lớn hơn. Mức độ kháng thể trung hòa được xem là "có tương quan với hiệu lực bảo vệ của vaccine".
Vaccine Covivac được IVAC nghiên cứu và phát triển từ tháng 5/2020, dựa trên chủng virus gây bệnh Newcastle (NDV) tái tổ hợp. Đại diện IVAC cho biết: "Vaccine có triển vọng, đạt yêu cầu về tính an toàn, tính sinh miễn dịch".
Covivac là vaccine Covid-19 thứ hai do Việt Nam nghiên cứu. Vaccine Covid-19 nội địa đầu tiên là Nanocovax nghiên cứu dựa công nghệ tái tổ hợp, sử dụng những mảnh kháng nguyên vô hại (protein) thích hợp nhất của nCoV để kích thích tạo đáp ứng miễn dịch phù hợp. Nanocovax đang thử nghiệm giai đoạn ba trên 14.000 người với mức liều 25 mcg, hiệu quả gần 52% sau 180 ngày.
VNE